Альдегиддер - CH функционалдык тобун камтыган карбонил кошулмаларына тиешелүү органикалык заттар, ал карбонил тобу деп аталат.
Молекуланын углеводород скелетинин табиятына жараша альдегиддер каныккан, каныкпаган жана ароматтык болуп саналат. Алардын молекулалары галоген атомдорун же кошумча функциялык топторду да камтышы мүмкүн. Каныккан альдегиддердин жалпы формуласы C H2 O. IUPAC номенклатурасына ылайык, алардын аттары -al.
суффикси менен аяктайт.
Альдегиддердин кычкылдануусу өнөр жайда маанилүү, анткени алар оңой карбон кислоталарына айландырылат. Бул учурда жез гидроксиди, күмүш оксиди, жада калса атмосферадагы кычкылтек кычкылдандыруучу агент катары кызмат кыла алат.
Карбонил тобунун түзүлүшү
С=О тобундагы кош байланыштын электрондук структурасы бир σ-байланыш жана дагы бир π-байланыш түзүлүшү менен мүнөздөлөт. Атом C sp2-гибриддештирүү абалында, 1200 жакын байланыштардын ортосундагы байланыш бурчтары бар тегиздик молекула. Бул функционалдык топтогу кош байланыштын айырмасы анын көмүртек атому менен өтө электр терс кычкылтек атомунун ортосунда жайгашкандыгында. Натыйжадаэлектрондор О атомуна тартылат, демек бул байланыш абдан күчтүү поляризацияланган.
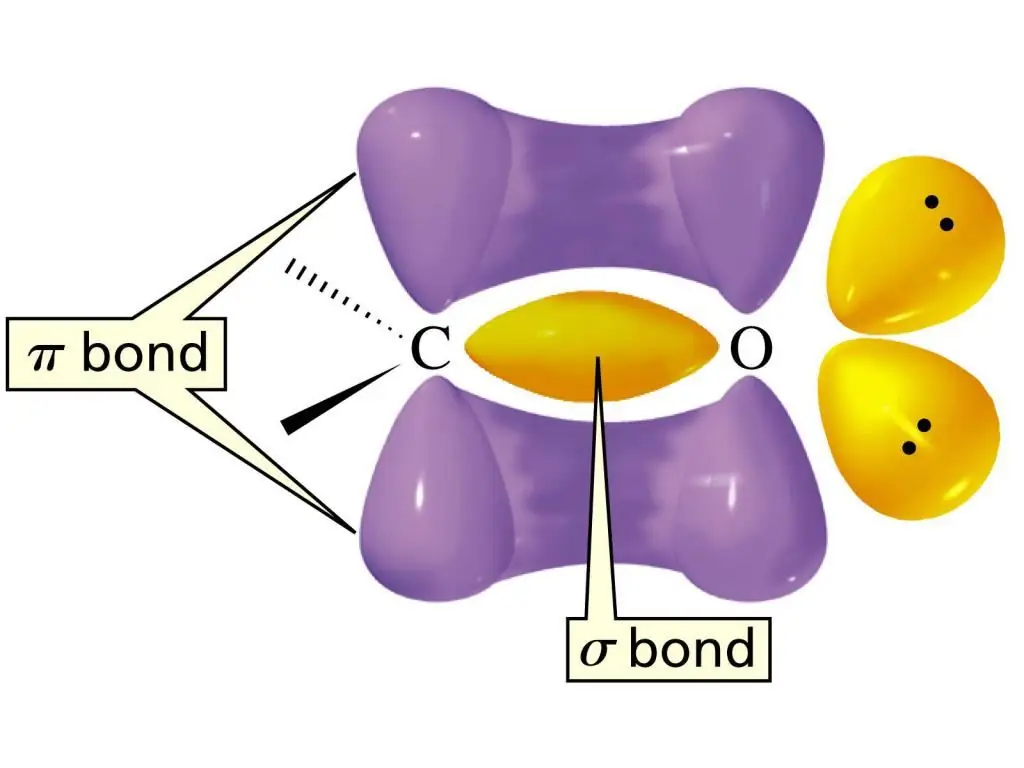
Альдегиддер тобундагы мындай поляризацияланган кош байланыштын мазмунун альдегиддердин жогорку реакцияга жөндөмдүүлүгүнүн негизги себеби деп атоого болот. Альдегиддер үчүн С=О байланышына атомдордун же алардын топторунун кошулуу реакциялары эң мүнөздүү. Ал эми нуклеофилдик кошулуу реакциялары эң оңой уланат. Альдегиддер үчүн альдегиддердин функционалдык тобунан Н атомдору катышкан реакциялар да мүнөздүү. С=О группасынын электрон тартып алуучу эффектисинен байланыштын полярдуулугу жогорулайт. Бул өз кезегинде альдегиддердин салыштырмалуу жеңил кычкылданышынын себеби болуп саналат.
Альдегиддердин кээ бир өкүлдөрү
Формальдегид (формальдегид же метанал) CH2O - өтө курч жыты бар газ түрүндөгү зат, ал көбүнчө метанол буусу менен абанын аралашмасын кызыл түстө өткөрүүдөн алынат. - жезден же күмүштөн жасалган ысык тор. Анын 40% суудагы эритмеси формалин деп аталат. Формальдегид реакцияларга оңой кирет, алардын көбү бир катар маанилүү заттардын өнөр жайлык синтезинин негизинде жатат. Ошондой эле изопрен каучук, пентаэритритол, көптөгөн дарылык заттар, ар түрдүү боёкторду алуу үчүн, терини идөө үчүн, дезинфекциялоочу жана дезодорант катары колдонулат. Формальдегид абдан уулуу, анын абадагы ЧДКсы 0,001 мг/л.
Ацетальдегид (уксус альдегиди, этанал) CH3SON - тумчугуучу жыты бар түссүз суюктук, суу менен суюлтулгандажемиш жыты. Ацетальдегид альдегиддердин бардык негизги касиеттерине ээ. Ацетальдегиддин кычкылданышы эбегейсиз көп өлчөмдөгү уксус кислотасын жана уксус ангидридин, ар кандай фармацевтикалык каражаттарды чыгарат.
Акролеин (пропенал) CH2=CH-SON, эң жөнөкөй тойбогон альдегид, түссүз, учуучу суюктук. Анын буулары көздүн жана жогорку дем алуу жолдорунун былжыр челдерин катуу дүүлүктүрөт. Абдан уулуу, абадагы анын курамындагы ЧДК 0,7 мг/м3. Пропенал - белгилүү бир полимерлердин синтезиндеги аралык продукт жана айрым дарыларды өндүрүүдө талап кылынат.

Бензалдегид (бензой альдегиди) С6Н5SON - түссүз суюктук, сактоо учурунда сары түскө айланат, ачуу бадам даамы бар. Абанын жардамы менен бензой кислотасына тез кычкылданат. Өсүмдүктөрдүн эфир майларында (нероли, пачули), ал эми глюкозид түрүндө - ачуу бадамдын, алчанын, абрикостун жана шабдалынын уруктарынын өзөгүндө болот. Жыпар жыттуу зат катары парфюмерияда, тамак-аш эссенцияларынын компоненти катары, башка жыпар жыттуу заттарды (циннамальдегид, жасминальдегид) синтездөө үчүн чийки зат катары колдонулат.
Күмүш күзгү реакциясы
Альдегиддердин күмүш оксиди менен кычкылданышы функционалдык топтун тиешелүү формасына эң маанилүү сапаттык реакция болуп саналат. Бул реакция пробирканын дубалдарындагы жука күмүш каптоодон улам ушундай аталышка ээ болгон, ал реакция учурунда пайда болгон.
Анын маңызы R-COH альдегидинин оксиддин аммиак эритмеси менен өз ара аракеттенүүсүндө жатат.күмүш(I), ал эрүүчү комплекстүү кошулма [Ag(NH3)2]OH жана Толленс реактиви деп аталат. Реакция суунун кайноо температурасына жакын температурада (80-100°С) жүргүзүлөт. Бул учурда альдегиддер тиешелүү карбон кислоталарына чейин кычкылданышат, ал эми кычкылдандыруучу зат металлдык күмүшкө чейин калыбына келтирилет, ал чөктүрөт.
Реагенттерди даярдоо
Альдегиддердеги -SON тобун сапаттык аныктоо үчүн алгач күмүш комплекстүү бирикме даярдалат. Ал үчүн пробиркага аммиактын (аммоний гидроксиди) суудагы бир аз эритмеси, андан кийин аз өлчөмдөгү күмүш нитраты куюлат. Бул учурда күмүш оксидинин пайда болгон чөкмөлөрү дароо жок болот:
2AgNO3 + 2NH3 + H2O -> Ag 2O↓ + 2NH4NO3
Ag2O + 4NΗ3 + Η2O -> 2[Ag (NΗ3)2]ОΗ
Ишенимдүү натыйжаларды щелоч менен даярдалган Толленстин реактиви берет. Бул үчүн 1 г AgNO3 10 г дистилденген сууда эритилип, ага бирдей көлөмдөгү концентрацияланган натрий гидроксиди кошулат. Натыйжада Ag2O чөкмөсү пайда болот, ал концентрацияланган аммоний гидроксидинин эритмеси кошулганда жок болот. Реакция үчүн жаңы даярдалган реагент гана колдонулушу керек.

Реакция механизми
Күмүш күзгүнүн реакциясы теңдемеге туура келет:
2[Ag(NΗ3)2]OΗ + НСОΗ-> 2Ag↓ + ΗCOONΗ4 + 3NΗ3 + H2O
Алдегиддер үчүн бул өз ара аракеттенүү жетиштүү изилдене электигин белгилей кетүү керек. Бул реакциянын механизми белгисиз, бирок радикалдык же иондук кычкылдануу варианты болжолдонууда. Диаммин күмүштүн гидроксиди диолдун күмүш тузунун пайда болушу менен кошулууга дуушар болот, андан күмүш андан соң карбон кислотасын түзүү үчүн ажырайт.
Ийгиликтүү эксперимент үчүн колдонулган идиштердин тазалыгы өтө маанилүү. Себеби, эксперимент учурунда пайда болгон коллоиддик күмүш бөлүкчөлөрү айнек бетине жабышып, күзгү бети пайда болушу керек. Кичинекей булгануу болгондо, ал боз топурактуу чөкмө болуп түшөт.
Идишти тазалоо үчүн щелоч эритмелери колдонулушу керек. Ошентип, бул максаттар үчүн NaOH эритмесин ала аласыз, аны көп көлөмдөгү дистилденген суу менен жууш керек. Айнек бетинде май жана механикалык бөлүкчөлөр болбошу керек.
Жез гидроксиди менен кычкылдануу
Альдегиддердин жез (II) гидроксиди менен кычкылдануу реакциясы да функционалдык топтун түрүн аныктоодо кыйла эффективдүү жана эффективдүү. Ал реакция аралашмасынын кайноосуна туура келген температурада жүрөт. Ошол эле учурда альдегиддер Фелинг реактивиндеги эки валенттүү жезди (Cu(OH)2 жаңы даярдалган аммиак эритмеси) бир валенттүү жезге чейин азайтат. Алардын өзүлөрү С-Н байланышына кычкылтек атомунун киришинен улам кычкылданышат (Стин кычкылдануу деңгээли +1ден +3кө чейин өзгөрөт).
Көчүрүүнүн артындаэритмелер аралашмасынын түсүн өзгөртүү аркылуу реакцияларды байкоого болот. Жез гидроксидинин көгүш чөкмөсү бара-бара сарыга айланат, бул бир валенттүү жез гидроксидине жана андан ары ачык кызыл түстөгү тунма Cu2O.
Бул процесс реакция теңдемесине туура келет:
R-SLEEP + Cu2+ + NaOH + H2O -> R-COONa + Cu 2O + 4H+

Джонс реактиви менен аракет
Мындай реагент альдегиддерге эң жакшы таасир этээрин белгилей кетүү керек. Мында кычкылдануу ысытууну талап кылбайт жана 0-20°С температурада жетишээрлик кыска мөөнөткө жүргүзүлөт, ал эми продукциянын чыгышы 80%дан ашат. Джонс реагентинин негизги кемчилиги башка функционалдык топтор үчүн жогорку тандоонун жоктугу, андан тышкары кислоталуу чөйрө кээде изомеризацияга же бузулууга алып келет.
Джонс реагенти - хром (VI) оксидинин суюлтулган күкүрт кислотасы менен ацетондогу эритмеси. Аны натрий бихроматынан да алууга болот. Альдегиддер кычкылданганда бул реагенттин таасири астында карбон кислоталары пайда болот.
Өнөр жайдагы кычкылтектин кычкылданышы
Өнөр жайда ацетальдегидди кычкылдандыруу катализаторлордун - кобальт же марганец иондорунун катышуусунда кычкылтектин таасири менен ишке ашырылат. Адегенде перассус кислотасы түзүлөт:
CH3-SLEEP + O2 -> CH3-UNOH
Ал, өз кезегинде, ацетальдегиддин экинчи молекуласы жана пероксид аркылуу өз ара аракеттенет.кошулма уксус кислотасынын эки молекуласын берет:
CH3-COOH + CH3-SON -> 2CH3-COOH
Оксидация 60-70 °C температурада жана 2 105 Па.
басымда жүргүзүлөт.
Йод эритмеси менен өз ара аракеттенүү
Альдегид топторун кычкылдандыруу үчүн кээде щелочтун катышуусунда йоддун эритмеси колдонулат. Бул реагент карбонгидрат кычкылдануу процессинде өзгөчө мааниге ээ, анткени ал абдан тандалма аракеттенет. Ошентип, анын таасири астында D-глюкоза D-глюкон кислотасына айланат.
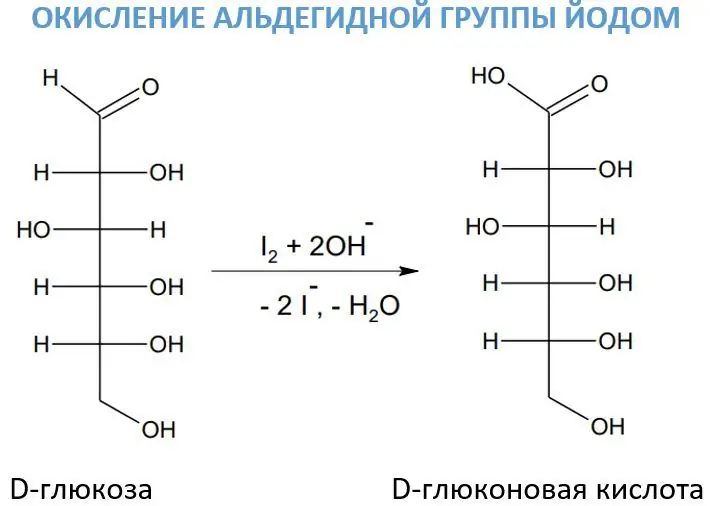
Йод щелочтордун катышуусунда гипоиодидди (өтө күчтүү кычкылдандыруучу агент) түзөт:.
Гипиодиддин таасири астында формальдегид метан кислотасына айланат: ΗСОΗ + NaIO + NaOΗ -> ΗCOONa + NaI + H2O.
Альдегиддерди йод менен кычкылдандыруу аналитикалык химияда алардын эритмелердеги сандык курамын аныктоо үчүн колдонулат.
Селений диоксиди менен кычкылдануу
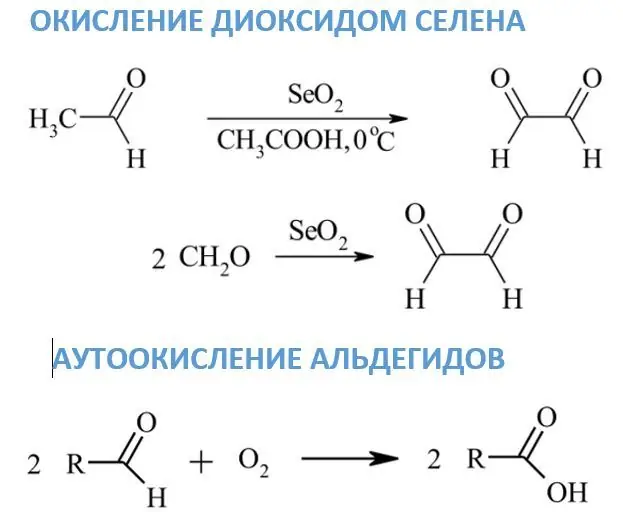
Мурунку реагенттерден айырмаланып, селен диоксидинин таасири астында альдегиддер дикарбонил бирикмелерине айланат, ал эми формальдегидден глиоксал пайда болот. Метилен же метил топтору карбонилдин жанында жайгашкан болсо, анда алар карбонилге айланышы мүмкүн. SeO2 үчүн эриткич катары көбүнчө диоксан, этанол же ксилол колдонулат.
Бир ыкма боюнча реакция аралаштыргычка, термометрге жана рефлюкс конденсаторго туташтырылган үч моюндуу колбада жүргүзүлөт. 0,25 моль өлчөмүндө алынган баштапкы затка тамчылатып эритме кошулат180 мл диоксанда 0,25 моль селен диоксиди, ошондой эле 12 мл H2О. Температура 20 °С ашпоого тийиш (зарыл болсо колбаны муздатуу керек). Андан кийин тынымсыз аралаштыруу менен эритме 6 саат кайнатылат. Андан ары ысык эритмени сүзүп, селенди бөлөт жана чөкмө диоксан менен жуулат. Эриткичтин вакуумдук дистилляциясынан кийин калдык фракцияларга бөлүнөт. Негизги бөлүк температуранын кең диапазонунда (20-30 °C) алынат жана кайра түзүлөт.
Альдегиддердин автооксидациясы
Атмосфералык кычкылтектин таасири астында бөлмө температурасында альдегиддердин кычкылдануусу өтө жай жүрөт. Бул реакциялардын негизги продуктылары тиешелүү карбон кислоталары болуп саналат. Авто-кычкылдануу механизми этаналдын уксус кислотасына өнөр жайлык кычкылданышына байланыштуу. Аралык заттардын бири башка альдегид молекуласы менен реакцияга кирген перасид.
Ракциянын бул түрү жарык, пероксиддер жана оор металлдардын издери менен тездетилгендигине байланыштуу анын радикалдуу механизми деген тыянак чыгарууга болот. Суудагы эритмелердеги формальдегид абада гидратталган метиленгликол түрүндө болгондугуна байланыштуу, анын аналогдорунан алда канча начар кычкылданат.

Альдегиддердин калий перманганаты менен кычкылданышы
Бул реакция кислоталуу чөйрөдө эң ийгиликтүү болот. Калий перманганат эритмесинин интенсивдүүлүгүн жоготуу жана кызгылт түстүн толук өзгөрүшү менен анын өтүшүн визуалдык түрдө баалай аласыз. Реакция учурда ишке ашатбөлмө температурасы жана нормалдуу басым, ошондуктан ал өзгөчө шарттарды талап кылбайт. Пробиркага 2 мл формальдегидди жана күкүрт кислотасы менен кычкылданган калий перманганатынын 1 мл эритмесин куюу жетиштүү. Реагенттерди аралаштыруу үчүн пробирканы эритме менен акырын чайкаңыз:
5CH3-SLEEP + 2KMnO4 + 3H2SO 4 =5CH3-COOH + 2MnSO4 + K2SO 4 + 3H2O
Эгерде ошол эле реакция жогорку температурада жүргүзүлсө, метанал жеңил көмүр кычкыл газына чейин кычкылданат:
5CH3-SLEEP + 4KMnO4 + 6H2SO 4 =5SO2 + 4MnSO4 + 2K2SO 4 + 11Н2O






