Термодинамикада системанын баштапкы абалынан акыркы абалына өтүүнү изилдөөдө процесстин жылуулук эффектисин билүү маанилүү. Жылуулук сыйымдуулугу түшүнүгү бул эффект менен тыгыз байланышта. Бул макалада биз газдын изохоралык жылуулук сыйымдуулугу деген эмнени билдирет деген суроону карап чыгабыз.
Идеалдуу газ
Идеал газ деп бөлүкчөлөрү материалдык чекиттер деп эсептелген, б.а. өлчөмдөрү жок, бирок массасы бар жана бардык ички энергиясы молекулалардын кыймылынын кинетикалык энергиясынан гана турган газды айтабыз. жана атомдор.
Кандайдыр бир реалдуу газ идеалдуу түрдө сүрөттөлгөн моделди эч качан канааттандырбайт, анткени анын бөлүкчөлөрү дагы эле кандайдыр бир сызыктуу өлчөмдөргө ээ жана алсыз ван-дер-Ваальс байланыштарын же башка түрдөгү химиялык байланыштарды колдонуу менен бири-бири менен өз ара аракеттенишет. Бирок төмөнкү басымда жана жогорку температурада молекулалардын ортосундагы аралыктар чоң жана алардын кинетикалык энергиясы потенциалдык энергиядан ондогон эсе ашып кетет. Мунун баары реалдуу газдар үчүн идеалдуу моделди жогорку тактык менен колдонууга мүмкүндүк берет.
Газдын ички энергиясы
Кандайдыр бир системанын ички энергиясы физикалык мүнөздөмө болуп саналат, ал потенциал жана кинетикалык энергиянын суммасына барабар. Идеалдуу газдарда потенциалдуу энергияны этибарга албай коюуга болот, ошондуктан алар үчүн теңдикти жаза алабыз:
U=Ek.
Мында Ek - кинетикалык системанын энергиясы. Молекулярдык-кинетикалык теорияны колдонуу жана универсалдуу Клапейрон-Менделеев абалынын теңдемесин колдонуу менен U үчүн туюнтманы алуу кыйын эмес. Ал төмөндө жазылган:
U=z/2nRT.
Бул жерде T, R жана n тиешелүүлүгүнө жараша абсолюттук температура, газдын туруктуулугу жана заттын саны. z-мааниси газ молекуласынын эркиндик даражаларынын санын көрсөткөн бүтүн сан.
Изобарикалык жана изохоралык жылуулук сыйымдуулугу
Физикада жылуулук сыйымдуулугу - бул изилденүүчү системаны бир келвинге ысытуу үчүн берилүүгө тийиш болгон жылуулуктун көлөмү. Тескери аныктама дагы туура, башкача айтканда, жылуулук сыйымдуулугу бул система бир келвин муздаганда бөлүп чыгарган жылуулуктун көлөмү.
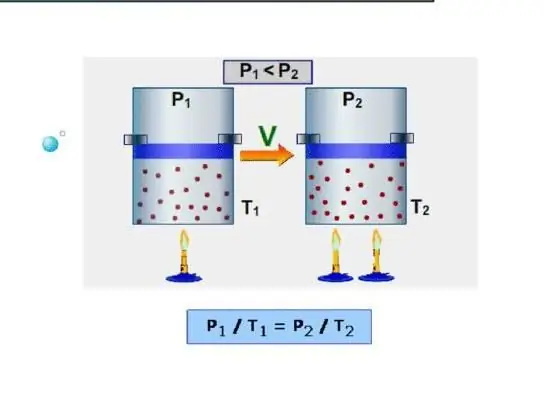
Системанын эң оңой жолу - изохоралык жылуулук сыйымдуулугун аныктоо. Бул туруктуу көлөмдө жылуулук сыйымдуулугу катары түшүнүлөт. Система мындай шарттарда жумуш аткарбагандыктан, бардык энергия ички энергия запастарын көбөйтүүгө жумшалат. Изохоралык жылуулук сыйымдуулукту CV символу менен белгилейли, анда төмөнкүдөй жаза алабыз:
dU=CVdT.
Тагыраак айтканда, ички энергиянын өзгөрүшүсистемасы анын температурасынын өзгөрүшүнө түз пропорционалдуу. Эгерде бул туюнтманы мурунку абзацта жазылган теңчилик менен салыштырсак, анда идеалдуу газдагы CV формуласына келебиз:
СV=z/2nR.
Бул маанини иш жүзүндө колдонуу ыңгайсыз, анткени системадагы заттын көлөмүнө жараша болот. Ошондуктан, өзгөчө изохоралык жылуулук сыйымдуулук түшүнүгү киргизилген, башкача айтканда, 1 моль газга же 1 кг үчүн эсептелген чоңдук. Биринчи маанини CV символу менен, экинчисин - CV символу менен белгилейли. m. Алар үчүн төмөнкү формулаларды жазсаңыз болот:
CV=z/2R;
CVm=z/2R/M.
Бул жерде M молярдык масса.
Изобарикалык - системада туруктуу басымды кармап турган жылуулук сыйымдуулугу. Мындай процесстин мисалы ысытылганда поршендин астындагы цилиндрдеги газдын кеңейүүсү. Изохоралык процесстен айырмаланып, изобар процессинде системага берилген жылуулук ички энергияны көбөйтүүгө жана механикалык иштерди аткарууга жумшалат, башкача айтканда:
H=dU + PdV.
Изобардык процесстин энтальпиясы - изобардык жылуулук сыйымдуулуктун жана системадагы температуранын өзгөрүшүнүн көбөйтүндүсү, башкача айтканда:
H=CPdT.
Эгер 1 моль газдын туруктуу басымында кеңейүүнү карасак, анда термодинамиканын биринчи мыйзамы төмөнкүчө жазылат:
CPdT=CV dT + RdT.
Акыркы мүчө теңдемеден алындыКлапейрон-Менделеев. Бул теңдиктен изобардык жана изохоралык жылуулук сыйымдуулуктардын ортосундагы байланыш келип чыгат:
CP=CV + R.
Идеалдуу газ үчүн, туруктуу басымдагы өзгөчө молярдык жылуулук сыйымдуулугу ар дайым R=8, 314 Дж/(мольК) тиешелүү изохоралык мүнөздөмөдөн чоңураак.
Молекулалардын эркиндик даражалары жана жылуулук сыйымдуулугу
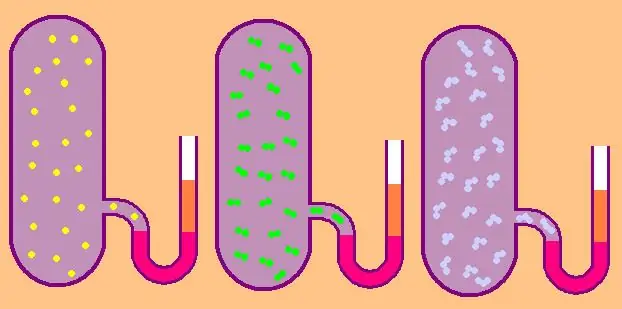
Келгиле, өзгөчө молярдык изохоралык жылуулук сыйымдуулуктун формуласын кайра жазалы:
CV=z/2R.
Монатомдуу газда z=3 мааниси, анткени мейкиндиктеги атомдор үч гана көз карандысыз багытта кыймылдай алат.
Эгер сөз эки атомдуу молекулалардан турган газ жөнүндө болсо, мисалы, кычкылтек O2 же суутек H2, анда, которуу кыймылынан тышкары, бул молекулалар дагы эле эки өз ара перпендикуляр октордун айланасында айланышы мүмкүн, башкача айтканда, z 5ке барабар болот.
Татаал молекулалар үчүн z=6 колдонуңуз. CV






