Газдын жылуулук сыйымдуулугу - бул дене бир градуска ысытылганда өзүнө алган энергиянын көлөмү. Бул физикалык чоңдуктун негизги мүнөздөмөлөрүн талдап көрөлү.

Аныктамалар
Газдын салыштырма жылуулугу - белгилүү бир заттын бирдик массасы. Анын өлчөө бирдиктери Дж/(кг·К). Агрегация абалын өзгөртүү процессинде организм сиңирген жылуулуктун көлөмү баштапкы жана акыркы абалы менен гана эмес, өтүү ыкмасы менен да байланыштуу.

Бөлүм
Газдардын жылуулук сыйымдуулугу туруктуу көлөмдө (Cv), туруктуу басымда (Cр) аныкталган чоңдукка бөлүнөт.
Кысымды өзгөртпөстөн жылытууда жылуулуктун бир бөлүгү газдын кеңейүү ишин өндүрүүгө, ал эми энергиянын бир бөлүгү ички энергияны көбөйтүүгө сарпталат.
Туруктуу басымдагы газдардын жылуулук сыйымдуулугу ички энергияны көбөйтүүгө жумшалган жылуулуктун көлөмү менен аныкталат.
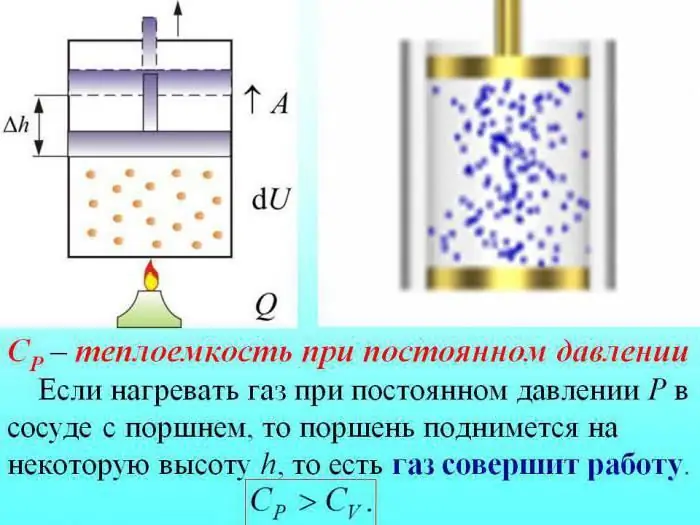
Газдын абалы: өзгөчөлүктөр, сүрөттөмө
Идеалдуу газдын жылуулук сыйымдуулугу Сp-Сv=R экендигин эске алуу менен аныкталат. Акыркы чоңдук универсалдуу газ константасы деп аталат. Анын мааниси 8,314 Дж/(моль К) туура келет.
Жылуулук сыйымдуулугунун теориялык эсептөөлөрүн жүргүзүүдө, мисалы, температура менен болгон байланышты сүрөттөөдө, термодинамикалык ыкмаларды гана колдонуу жетишсиз, статикалык физиканын элементтери менен куралдануу маанилүү.
Газдардын жылуулук сыйымдуулугу кээ бир молекулалардын которуу кыймылынын энергиясынын орточо маанисин эсептөөнү камтыйт. Мындай кыймыл молекуланын айлануу жана которуу кыймылынан, ошондой эле атомдордун ички термелүүсүнөн жыйынтыкталган.
Статикалык физикада айлануу жана которуу кыймылынын эркиндигинин ар бир даражасы үчүн универсалдуу газ константасынын жарымына барабар болгон газ үчүн чоңдук бар деген маалымат бар.

Кызыктуу фактылар
Монатомдук газдын бөлүкчөсүнүн эркиндиктин үч котормо даражасы бар деп эсептелет, ошондуктан газдын салыштырма жылуулугу үч которуу, эки айлануу жана бир термелүү эркиндик даражасына ээ. Алардын бирдей бөлүштүрүү мыйзамы туруктуу көлөмдөгү салыштырма жылуулукту R ге барабар кылууга алып келет.
Тажрыйбалардын жүрүшүндө эки атомдуу газдын жылуулук сыйымдуулугу R чоңдугуна туура келери аныкталды. Теория менен практиканын мындай карама-каршылыгы идеалдуу газдын жылуулук сыйымдуулугу квант менен байланышкандыгы менен түшүндүрүлөт. эффекттер, ошондуктан эсептөөлөрдү жүргүзүүдө кванттык статистиканы колдонуу маанилүүмеханика.
Кванттык механиканын негиздеринин негизинде термелүүчү же айлануучу бөлүкчөлөрдүн ар кандай системасы, анын ичинде газ молекулалары энергиянын айрым гана дискреттик маанилерине ээ.
Эгер системадагы жылуулук кыймылынын энергиясы белгилүү жыштыктагы термелүүлөрдү дүүлүктүрүү үчүн жетишсиз болсо, мындай кыймылдар системанын жалпы жылуулук сыйымдуулугуна салым кошо албайт.
Натыйжада эркиндиктин спецификалык даражасы «тоңуп калат», ага тең бөлүшүү мыйзамын колдонуу мүмкүн эмес.
Газдардын жылуулук сыйымдуулугу бүткүл термодинамикалык системанын иштеши көз каранды болгон абалдын маанилүү мүнөздөмөсү болуп саналат.
Температуранын тең бөлүү мыйзамы эркиндиктин термелүү же айлануу даражасына колдонулушу мүмкүн болгон температура кванттык теория менен мүнөздөлөт, Планк константасын Больцман туруктуусу менен байланыштырат.

Диатомдук газдар
Мындай газдардын айлануу энергетикалык деңгээлдеринин ортосундагы боштуктар аз сандагы градустарды түзөт. Температуранын мааниси жүздөгөн градус менен аныкталуучу суутек өзгөчөлүгү болуп саналат.
Ошондуктан туруктуу басымдагы газдын жылуулук сыйымдуулугун бирдей бөлүштүрүү мыйзамы менен сүрөттөп берүү кыйын. Кванттык статистикада жылуулук сыйымдуулугун аныктоодо анын термелүү бөлүгү температуранын төмөндөшүндө тез азайып, нөлгө жетээри эске алынат.
Бул көрүнүш бөлмө температурасында жылуулук сыйымдуулугунун термелүү бөлүгүнүн дээрлик жок экендигин түшүндүрөт,эки атомдуу газ, ал туруктуу Rга туура келет.
Төмөн температура көрсөткүчтөрүндөгү газдын туруктуу көлөмдөгү жылуулук сыйымдуулугу кванттык статистиканын жардамы менен аныкталат. Термодинамиканын үчүнчү мыйзамы деп аталган Нерст принциби бар. Анын формуласынын негизинде газдын молярдык жылуулук сыйымдуулугу температуранын төмөндөшү менен төмөндөп, нөлгө барабар болот.

Катуу заттардын өзгөчөлүктөрү
Эгер газдардын аралашмасынын жылуулук сыйымдуулугун кванттык статистиканын жардамы менен түшүндүрүүгө мүмкүн болсо, анда агрегаттын катуу абалы үчүн жылуулук кыймылы тең салмактуулук абалына жакын бөлүкчөлөрдүн бир аз термелүүлөрү менен мүнөздөлөт.
Ар бир атомдун үч термелүү эркиндик даражасы бар, ошондуктан, эквиваленттүүлүк мыйзамына ылайык, катуу заттын молярдык жылуулук сыйымдуулугу 3nR катары эсептелсе болот, мында n молекуладагы атомдордун саны болуп саналат.
Практикада бул сан катуу дененин жылуулук сыйымдуулугунун жогорку температурага умтулган чеги.
Кээ бир элементтер, анын ичинде металлдар үчүн кадимки температурада максималдуу көрсөткүчтү алууга болот. n=1 үчүн Дюлонг жана Пети закону аткарылат, бирок татаал заттар үчүн мындай чекке жетүү кыйла кыйын. Чындыгында чекти алуу мүмкүн болбогондуктан, катуу заттын ажыроо же эрүү процесси болот.
Кванттык теориянын тарыхы
Квант теориясынын негиздөөчүлөрү 20-кылымдын башында Эйнштейн жана Дебай. Ал белгилүү бир жерде атомдордун термелүү кыймылдарын кванттоого негизделгенкристалл. Температуранын төмөн көрсөткүчтөрүндө катуу дененин жылуулук сыйымдуулугу куб болуп алынган абсолюттук мааниге түз пропорционалдуу болуп чыгат. Бул мамиле Дебайдын мыйзамы деп аталды. Төмөнкү жана жогорку температуранын көрсөткүчтөрүн айырмалоого мүмкүндүк берүүчү критерий катары аларды Дебай температурасы менен салыштыруу алынган.
Бул маани денедеги атомдун термелүү спектри менен аныкталат, ошондуктан ал анын кристаллдык түзүлүшүнүн өзгөчөлүктөрүнөн көз каранды.
QD - бир нече жүз К болгон маани, бирок, мисалы, алмазда ал бир топ жогору.
Өткүрүүчү электрондор металлдардын жылуулук сыйымдуулугуна чоң салым кошот. Аны эсептөө үчүн Ферми кванттык статистикасы колдонулат. Металл атомдорунун электрондук өткөргүчтүгү абсолюттук температурага түз пропорционалдуу. Ал анча чоң эмес маани болгондуктан, абсолюттук нөлгө тенденцияланган температураларда гана эске алынат.
Жылуулук сыйымдуулугун аныктоо ыкмалары
Негизги эксперименттик метод - калориметрия. Жылуулук сыйымдуулугунун теориялык эсебин жүргүзүү үчүн статистикалык термодинамика колдонулат. Ал идеалдуу газ үчүн, ошондой эле кристаллдык денелер үчүн жарактуу, заттын түзүлүшү боюнча эксперименталдык маалыматтардын негизинде жүргүзүлөт.
Идеал газдын жылуулук сыйымдуулугун эсептөөнүн эмпирикалык ыкмалары химиялык түзүлүштүн идеясына, атомдордун айрым топторунун Ср салымына негизделген.
Суюктуктар үчүн термодинамикалык колдонууга негизделген ыкмалар да колдонулатбуулануу процессинин энтальпиясынын температурасынын туундусу аркылуу идеалдуу газдын жылуулук сыйымдуулугунан суюктукка өтүүгө мүмкүндүк берүүчү циклдер.
Эритмеде жылуулук сыйымдуулугун кошумча функция катары эсептөөгө жол берилбейт, анткени эритменин жылуулук сыйымдуулугунун ашыкча мааниси негизинен маанилүү.
Аны баалоо үчүн бизге эритмелердин молекулалык-статистикалык теориясы керек. Эң кыйыны - термодинамикалык анализде гетерогендик системалардын жылуулук сыйымдуулугун аныктоо.

Тыянак
Жылуулук сыйымдуулугун изилдөө химиялык реакторлордо, ошондой эле башка химиялык өндүрүш аппараттарында болуп жаткан процесстердин энергетикалык балансын эсептөөгө мүмкүндүк берет. Мындан тышкары, бул маани муздаткычтардын оптималдуу түрлөрүн тандоо үчүн зарыл.
Учурда заттардын жылуулук сыйымдуулугун ар кандай температуралык интервалдар үчүн - төмөнкү чоңдуктан жогорку чоңдуктарга чейин эксперименталдык түрдө аныктоо - заттын термодинамикалык мүнөздөмөлөрүн аныктоонун негизги варианты. Заттын энтропиясын жана энтальпиясын эсептөөдө жылуулук сыйымдуулуктун интегралдары колдонулат. Белгилүү бир температура диапазонундагы химиялык реагенттердин жылуулук сыйымдуулугу жөнүндө маалымат процесстин жылуулук эффектисин эсептөөгө мүмкүндүк берет. Эритмелердин жылуулук сыйымдуулугу жөнүндө маалымат алардын термодинамикалык параметрлерин талдоочу интервалдын ичинде каалаган температуралык мааниде эсептөөгө мүмкүндүк берет.
Мисалы, суюктук потенциалдык энергиянын маанисин өзгөртүү үчүн жылуулуктун бир бөлүгүнүн чыгымдалышы менен мүнөздөлөт.реакциядагы молекулалар. Бул маани чечимдерди сүрөттөө үчүн колдонулган "конфигурация" жылуулук сыйымдуулугу деп аталат.
Заттын термодинамикалык мүнөздөмөлөрүн, анын агрегаттык абалын эсепке албай туруп, толук кандуу математикалык эсептөөлөрдү жүргүзүү кыйын. Мына ошондуктан суюктуктар, газдар, катуу заттар үчүн заттын энергетикалык параметрлерин мүнөздөөгө мүмкүндүк берүүчү салыштырма жылуулук сыйымдуулугу сыяктуу мүнөздөмө колдонулат.






